1月23日,生命科学学院卢晓凤博士、附属医院王晓宁博士、研究生李博文为第一作者,在美国心脏学会(AHA)知名杂志Arteriosclerosis, Thrombosis, and Vascular Biology(动脉硬化、血栓形成和血管生物学)上发表了题为“Monocyte-Derived cxcl12 Guides a Directional Migration of Blood Vessels in Zebrafish”的研究论文。生命科学学院刘东教授、段旭初博士为论文通讯作者,南通大学为论文唯一通讯单位。
组织和器官的血管化过程是一个复杂且精密的生物学过程,对胚胎发育、组织修复和维持机体正常功能至关重要。整个器官血管化过程受到多种因素的精细调控,包括生长因子、细胞外基质、信号通路以及细胞间的相互作用等,这些因素协同作用,确保血管能够准确、有序地形成和发育,为器官的正常生长、发育和功能维持提供必要的支持。血管的定向迁移和连接是器官或者组织构建正确血管网络的关键环节,但长期以来,精确调控血管定向迁移的引导信号有待进一步明确;这些信号的细胞来源还未见报道。
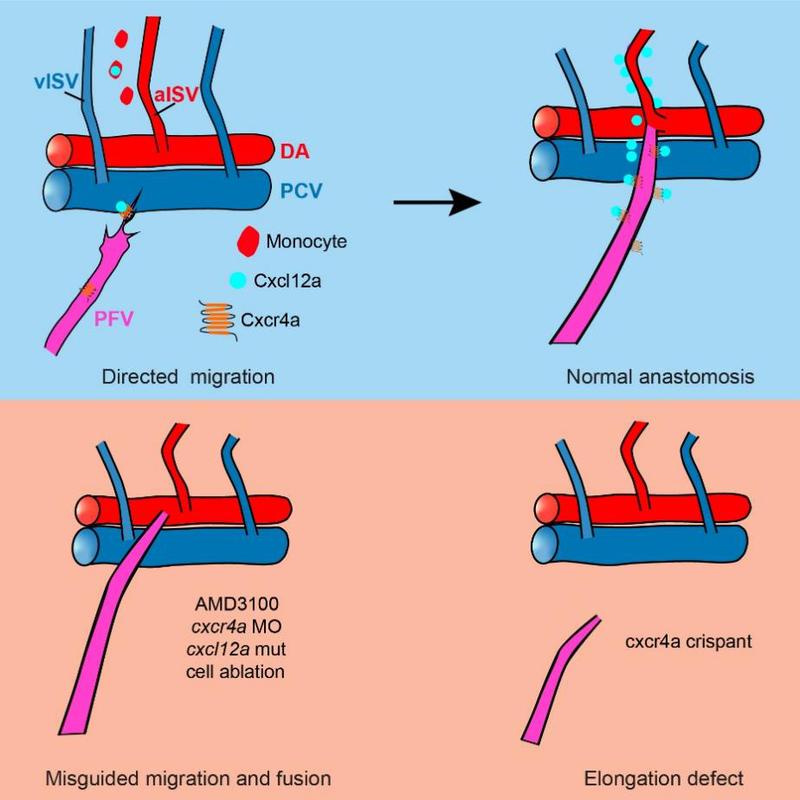
该团队借助活体成像技术,阐释了胸鳍血管的发育过程,并发现胸鳍血管动脉分支(PFVc)会历经长距离迁移,精准地与第二对节间血管吻合。探究其分子机制,研究人员发现cxcl12a-cxcr4a信号轴在其中起着核心作用。通过单细胞转录组测序、原位杂交等技术手段发现趋化因子受体cxcr4a在发育中的胸鳍血管内皮细胞有较高表达,而没有检测到其他受体的显著表达。原位杂交筛选发现其配体cxcl12a则在第二对节间血管附近特异性高表达。抑制或过表达该信号轴相关基因,均导致PFVc生长方向异常,并形成错误连接,证实了其关键引导作用。进一步通过单细胞转录组测序的数据分析、细胞消融、荧光原位杂交等实验数据表明,一群表达gata1a的单核细胞是cxcl12a的主要来源。该群单核细胞分泌的cxcl12a,引导着血管的迁移和吻合。该研究发现了器官血管化过程中一种长距离的血管迁移和吻合过程,首次明确了单核细胞来源的Cxcl12a-Cxcr4在血管定向迁移和吻合中的关键作用,为脊椎动物器官特异性血管化机制的研究提供了全新的细胞生物学机制。
该研究获得国家自然科学基金及南通市科技局项目资助。《Arteriosclerosis, Thrombosis, and Vascular Biology》是中科院1区TOP期刊,五年影响因子8.1。
原文链接:https://www.ahajournals.org/doi/10.1161/ATVBAHA.124.321588
(卢晓凤)